El Síndrome de Las Bolitas tiene un impacto severo en el sistema digestivo de larvas de P. vannamei, en contraste con la ausencia de características patogénicas en larvas sanas

Durante finales de los años 1980, 1990 y principios de los años 2000, las patologías más predominantes en los criaderos de camarones en América Latina fueron el Síndrome Larval de Las Bolitas (LBS), el Síndrome de Zoea 2 y el Síndrome de Muda de Mysis. Durante el mismo período, las principales patologías reportadas en postlarvas (PL) fueron bacterias luminiscentes. Después de 2015, brotes de enfermedades con altas tasas de mortalidad se observaron con mayor frecuencia en la producción postlarval, por ejemplo, la Enfermedad de Necrosis Hepatopancreática Aguda postlarval, AHPND (PL-AHPND), la Enfermedad Postlarval Translúcida (TPD) y otras.
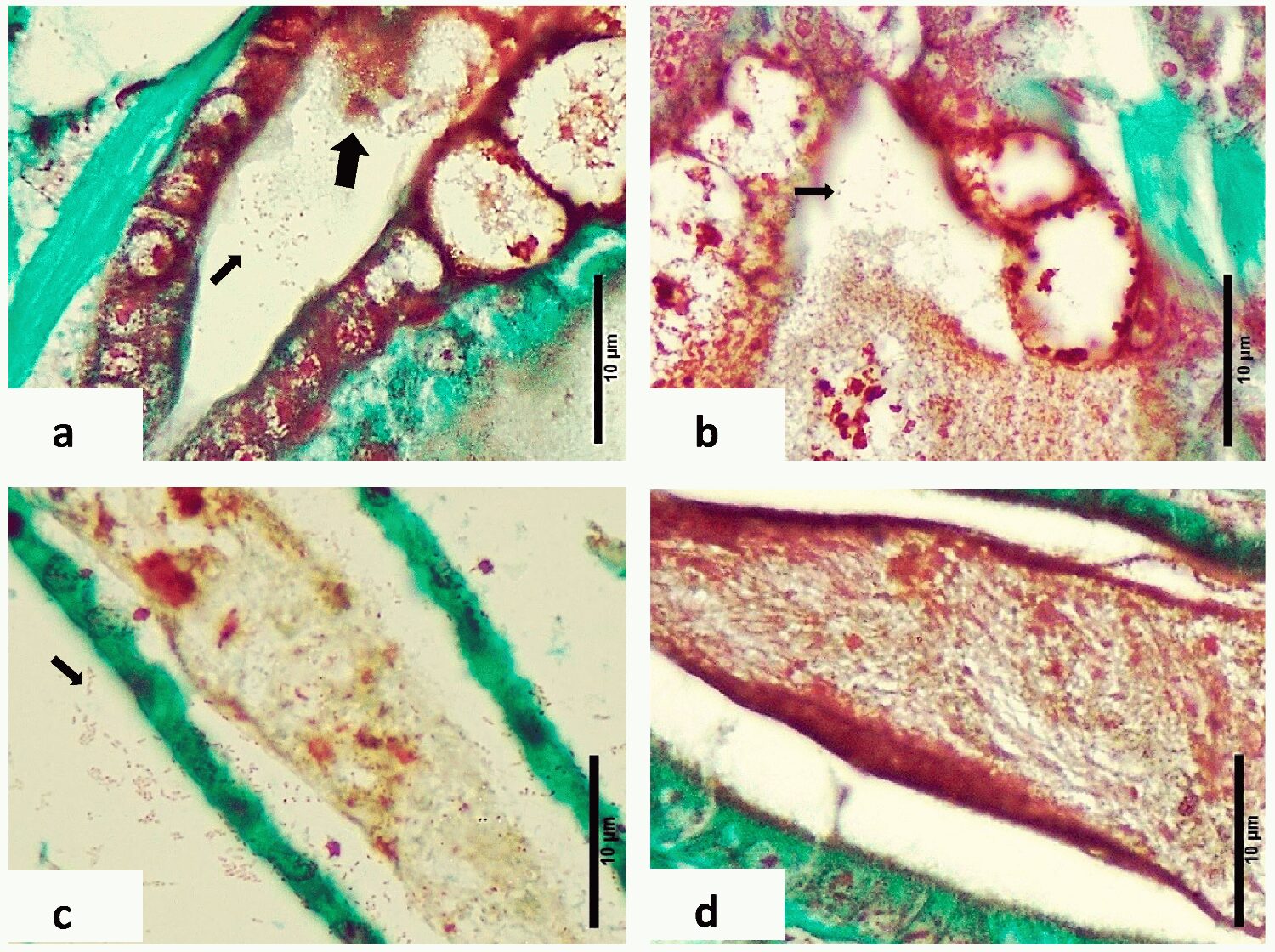
El Síndrome de Bolitas Larval (LBS) es una afección que inicialmente se caracteriza por una patología distintiva del hepatopáncreas, donde hay un desprendimiento celular del epitelio del hepatopáncreas, formando esferas, que finalmente se mueven hacia el intestino superior. La patología macroscópica del LBS normalmente se desarrolla en cuestión de horas, desde zoea bien alimentada y saludable hasta animales moribundos vacíos. Al mismo tiempo, las larvas se vuelven bioluminiscentes, lo que se acompaña de cambios en el comportamiento y pérdida de apetito. Aunque el LBS puede ocurrir durante las etapas postlarvales (PL), se han observado mortalidades masivas, que alcanzan hasta el 90 por ciento, principalmente en las etapas anteriores de zoea y mysis. Una característica distintiva del LBS es la presencia de bolitas (“pequeñas bolas” o “esferas” en Español) en el hepatopáncreas, que eventualmente migran al intestino.
El LBS se ha asociado con la infección de Vibrio spp. El Síndrome de Zoea 2 solo se asoció con V. harveyi y V. alginolyticus, y nunca se identificó la especie patógena asociada con el Síndrome de Mysis. La luminiscencia nocturna observada en criaderos tanto en Asia como en las Américas se atribuyó típicamente a Vibrio luminiscente. En tiempos más recientes, los brotes de mortalidades repentinas y agudas en criaderos de camarones peneidos generalmente comienzan en las etapas PL, desde un estado activo y aparentemente saludable hasta moribundo y muerto. La velocidad y virulencia con la que ocurren estas mortalidades masivas se han observado en muchas instalaciones de producción y, en la mayoría de los casos, se han asociado o vinculado a diferentes cepas de Vibrio.
Intriago et al. presentaron evidencia que la causa de estos rápidos eventos de mortalidad fue una especie de Vibrio que portaba los mismos plásmidos que el VpAHPND, que se informó que causaba la enfermedad de Necrosis Hepatopancreática Aguda (AHPND) en camarones cultivados en estanques en otros lugares. La afección se denominó provisionalmente AHPND de postlarva (PL-AHPND) para diferenciarla de otras patologías que afectan a las larvas de camarones peneidos. En Asia, la Enfermedad de Postlarvas Translúcidas (TPD) ha sido la principal causa de enfermedad y mortalidad larvaria, donde el agente causal es una cepa de V. parahaemolyticus que porta un gen particular. En la India, se ha descrito una afección similar conocida como Síndrome de Zoea 2 que afecta a las zoeas 2 de P. vannamei.
En Septiembre de 2023, algunas instalaciones de producción de larvas de camarón en la región de América Latina experimentaron altas mortalidades en los estadios 2 y 3 de zoea. Dada la alta tasa de mortalidad, estos tanques fueron descartados. No se ha informado sobre el agente causal asociado a esas mortalidades. La observación microscópica de las larvas afectadas reveló la presencia de “bolitas” (esferas) en el hepatopáncreas. En general, los indicadores clínicos y la apariencia macroscópica en preparaciones húmedas se alinearon con lo que se identificó previamente como LBS.
Este artículo – resumido de la publicación original (Intriago, P. et al. 2024. Las Bolitas Syndrome in Penaeus vannamei Hatcheries in Latin America. Microorganisms 2024, 12(6), 1186) – informa sobre los estudios microbiológico y de reacción en cadena de la polimerasa (PCR), y de los hallazgos histológicos de animales sanos y enfermos que padecen esta condición.
Configuración del estudio
Se tomaron muestras de larvas de P. vannamei de dos criaderos en América Latina (no se revelan los detalles de la ubicación exacta debido a que las instalaciones solicitaron confidencialidad). Se tomaron muestras para microbiología, PCR e histopatología de dos tanques de cada criadero. Se seleccionaron los criaderos porque uno de ellos había informado de una alta mortalidad en las etapas 2 y 3 de zoea, mientras que el otro criadero, con zoeas 2 y 3 aparentemente sanas, se seleccionó como control. Cabe señalar que los camarones muestreados para PCR e histología eran individuos diferentes de las mismas poblaciones. Para proteger la privacidad del cliente, no se revelará el país ni la ubicación precisa de cada instalación de cultivo de la que se obtuvieron las muestras.
Para obtener información detallada sobre la recolección, el procesamiento y los análisis de larvas de camarón realizados en este estudio, consulte la publicación original.
Resultados y discusión
Este estudio describe las lesiones histopatológicas, PCR y microbiología de muestras de zoeas de P. vannamei recolectadas de dos criaderos diferentes en América Latina: uno con un brote de Síndrome de Bolitas Larval, LBS, y el otro con animales aparentemente sanos. De todos los patógenos que se analizaron por PCR, las únicas diferencias clave entre el LBS y las zoeas sanas fueron la detección de Vibrio y bacterias similares a Rickettsia, RLB, más abundantes en las zoeas enfermas.
La presencia del Virus Wenzhou del camarón – WzSV8 – en las zoeas sanas requiere más estudios; este virus ARN se ha encontrado en una amplia gama de ambientes y regiones diferentes, incluyendo reproductores de camarón silvestres, y su efecto en la producción de peneidos necesita ser objeto de estudios adicionales.

La microbiología mostró que el número total de bacterias cultivables (TSA) fue un orden de magnitud mayor en las zoeas afectadas y el número de Vibrio presunto fue casi dos órdenes de magnitud mayor en comparación con la zoea sana. El Vibrio presunto representó el 17 por ciento y el 6 por ciento de la población bacteriana total en las zoeas enfermas y sanas, respectivamente. Las colonias verdes (en TCBS) y las colonias malva, que son presuntamente V. parahaemolyticus, representaron el 0,2 por ciento y el 82 por ciento del recuento total de Vibrio en las zoea afectadas, mientras que se observó un patrón inverso en las zoeas sanas, que tenían el 56 por ciento y el 2 por ciento, respectivamente.
Este hallazgo es interesante porque la suposición común es que las colonias verdes en TCBS y las colonias púrpuras en Vibrio CHROMagar™ (un medio selectivo para el aislamiento y la detección de especies particulares de Vibrio) generalmente representan V. parahaemolyticus. En este sentido, los investigadores que estudiaron las características fenotípicas y la cinética de crecimiento de tres cepas de V. parahaemolyticus con diferente virulencia y una cepa no patógena descubrieron que, independientemente de la virulencia de la cepa, existía una alta diversidad metabólica, lo que produjo fenotipos de diferentes colores en el medio Vibrio CHROMagar™.
Es importante destacar que las 14 cepas fueron identificadas por PCR como miembros del género Vibrio, por lo que se puede concluir que los resultados de API 20E (kit de prueba para identificar bacterias Gram-negativas) (21 por ciento de identificación falsa a nivel de género) no fueron confiables y deben tomarse con precaución. Si bien otros investigadores han informado que API 20E es un sistema válido para su uso en la identificación de los miembros más comunes de la familia Vibrionaceae, se ha informado que el sistema da como resultado falsos negativos. La identificación de API se basa en perfiles bioquímicos, pero se ha descubierto que los perfiles bioquímicos y el genotipo no están necesariamente asociados con el potencial de virulencia. La relación entre la variación o las diferencias en las identificaciones de API 20E y la posible virulencia y variación de género de cada cepa requiere más investigación.
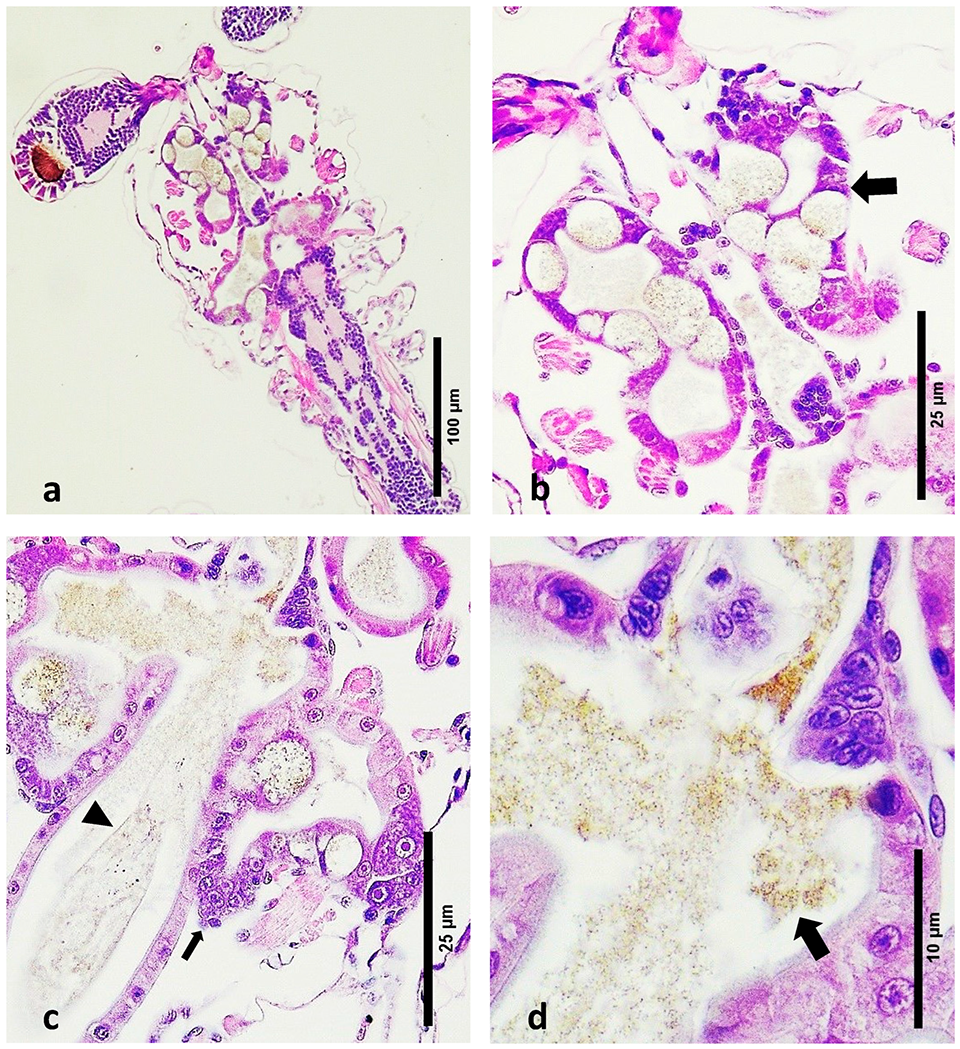
No es posible realizar una comparación entre la histología de este estudio y el primer informe de LBS informado por Morales (Memorias del Primer Congreso Ecuatoriano de Acuicultura; Escuela Superior Politécnica del Litoral: Guayaquil, Ecuador, 1992; pp. 203–207). Desafortunadamente, solo se presentaron imágenes de microscopía electrónica de transmisión (TEM) y no se registraron secciones de tejido teñidas con H&E. La publicación de Robertson et al. muestra la presencia de haces necróticos melanizados en los túbulos hepatopancreáticos, pero no observamos esto en la presente investigación; la razón más probable fue que los animales que utilizaron para la histología no eran zoea, sino que estaban al menos en la etapa PL1.
Una diferencia importante entre la patología presentada aquí para LBS y para PL-AHPND es que no hay desprendimiento masivo de células en el hepatopáncreas, como se describió para PL-AHPND. Además, PL-AHPND nunca se encontró ni se describió en zoea, y no se detectaron genes PirAB de AHPND, ni otros genes patógenos. Un material similar presente en larvas de camarón criadas en China y que sufrieron mortalidades durante la etapa 2 de zoea ha sido descrito por otros autores; en su caso esto se asoció con una cepa de V. alginolyticus.

Históricamente, el sector camaronero Latinoamericano ha seguido el modelo Ecuatoriano, donde las postlarvas se producen a partir de reproductores obtenidos de estanques de producción. Los reproductores se seleccionan en función del peso y luego se transfieren a un criadero para producir la siguiente generación de postlarvas. Este proceso proporciona poco o ningún control a largo plazo sobre la bioseguridad. Además, las altas concentraciones de Vibrio spp. pueden ser muy comunes en criaderos de peneidos no bioseguros o en aquellos que no están libres de patógenos específicos, tanto libres como adheridos a las larvas.
Desde la eclosión hasta la cosecha, el entorno microbiológico es una sopa de bacterias y partículas similares a virus (VLPs). A medida que las larvas pasan de una dieta basada en algas como zoeas a animales que se alimentan de proteínas como mysis, las larvas experimentan un cambio drástico en el volumen del hepatopáncreas y la bioquímica de las enzimas digestivas. En zoeas, la filtración de partículas es casi indiscriminada. Como las etapas de zoea están expuestas a concentraciones muy altas de bacterias, tanto de vida libre como adheridas, incluidas las Vibrio, que se ingieren fácilmente y pueden pasar al tracto digestivo, se pueden observar los efectos perjudiciales resultantes, que dependen de varios factores, como la etapa larvaria involucrada, las especies de Vibrio presentes y su concentración.
En 1997, Intriago y Jiménez (informe no publicado) replicaron el síndrome de Bolitas en zoeas de P. vannamei utilizando una cepa luminiscente de V. harveyi a concentraciones tan bajas como 10^3 células por mL. Curiosamente, esta cepa se aisló de P. vannamei de granja enfermos afectados por enteritis hemocítica. Ellos postularon que los patógenos podrían estar rebotando desde los criaderos a los reproductores o viceversa y que las diferencias encontradas en la histopatología entre las larvas y los adultos podrían haberse atribuido a las diferencias en el grado de desarrollo de los órganos, o a la especie del patógeno, su virulencia y su concentración.
El evento clave en la aparición de enfermedades podría ser la presencia de estrés (debido a la temperatura, salinidad, densidad, toxinas y otros) debido a fluctuaciones en el ambiente, y esto ejerce un cambio en la interacción huésped-patógeno y la transmisión de bacterias entre especies. Estas modificaciones actúan sobre los patógenos para facilitar su mayor transmisión entre huéspedes individuales y un mayor contacto con nuevas poblaciones o especies hospedadoras y sobre la selección, presión que lleva al predominio de cepas de patógenos adaptadas a estas nuevas condiciones ambientales.
Lamentablemente, no es posible comparar la histología de este estudio con la de informes publicados previamente, aunque la histología de este estudio se asemeja al Síndrome de Zoea 2 reportado por Kumar et al. Sin embargo, las diferencias en la patología podrían ser el producto de diferentes respuestas del huésped a un genotipo bacteriano dinámico amplio y la concentración de patógenos bacterianos. Además, dos patógenos también podrían producir la misma patología macroscópica, pero las diferencias en el daño a nivel tisular dependerán de todos los factores descritos anteriormente.
Evaluación del riesgo de transmisión en camarones cocidos infectados con WSSV
Perspectivas
De la información presentada aquí, es claro que ningún virus estuvo involucrado en este brote de enfermedad. Aunque se detectaron algunos virus por PCR, no se encontraron cuerpos de inclusión ni lesiones asociadas. También podemos eliminar patologías comunes de Vibrio como AHPND o el nuevo V. parahaemolyticus altamente letal descrito para larvas de P. vannamei que portan los genes Vhp1- y Vhp-2. Las 14 cepas bacterianas aisladas fueron identificadas como Vibrio por PCR.
Es tentador sugerir que Vibrio desempeñó un papel en la patogenicidad, sin embargo, no podemos descartar RLB o alguna toxicidad en el agua de cultivo. Sin embargo, podemos concluir que las especies de Vibrio como bacterias patógenas u oportunistas desempeñan un papel importante tanto en LBS como en tanques sanos, y en general se caracterizaron por una alta diversidad metabólica que produjo fenotipos de diferentes colores en el Vibrio CHROMagar™.
El examen histopatológico de las larvas de zoea de etapas 2 y 3 afectadas por LBS reveló cambios patológicos significativos, incluido el desprendimiento de células epiteliales, necrosis hepatopancreática, membranas peritróficas rotas y la presencia de bacterias Gram-negativas. Estos hallazgos resaltan el grave impacto de LBS en el sistema digestivo de las larvas de P. vannamei, que contrasta marcadamente con las estructuras intactas y la ausencia de características patógenas en las larvas sanas. Se necesita más investigación para comprender completamente la etiología de LBS y desarrollar intervenciones efectivas para mitigar sus efectos en los criaderos de camarones.
Los clientes enviaron muestras para monitorear el estado de salud de los camarones o los brotes de enfermedades en sus criaderos. Los animales (zoea) utilizados como controles estaban generalmente sanos y se recolectaron como especímenes de referencia para compararlos con los animales afectados. Este estudio no fue un estudio epidemiológico, sino un simple análisis de prevalencia de varios patógenos del camarón en muestras proporcionadas al azar de un criadero que informó mortalidad. Desafortunadamente, los propietarios y administradores no revelan información sobre los protocolos utilizados o los parámetros físicos y químicos del cultivo, ya que creen que podría dañar la reputación del criadero. En consecuencia, no podemos realizar un muestreo más extenso ni brindar información detallada relacionada con el cultivo de larvas.
Ahora que Ud. ha llegado al final del artículo...
… por favor considere apoyar la misión de la GSA de promover prácticas responsables de productos del mar a través de la educación, la defensa y las garantías de terceros. El Advocate tiene como objetivo documentar la evolución de las prácticas responsables de productos del mar y compartir el amplio conocimiento de nuestra amplia red de colaboradores.
Al hacerse miembro de la Global Seafood Alliance, está asegurando de que todo el trabajo pre-competitivo que hacemos a través de los beneficios, recursos y eventos para miembros pueden continuar. La membresía individual cuesta solo $50 al año.
¿No es miembro de la GSA? Únase a nosotros.
Author
-
Pablo Intriago, Ph.D.
Corresponding author
South Florida Farming Corporation, 13811 Old Sheridan St, Southwest Ranches, FL 33330, USA
Tagged With
Related Posts

Innovation & Investment
Artemia, el ‘polvo mágico’ que alimenta una industria multimillonaria
Artemia, el camarón microscópico de salmuera utilizado como alimento en los criaderos, son los héroes no reconocidos de la acuacultura. Los expertos dicen que la Artemia sigue inspirando la innovación más de 50 años después de su comercialización inicial. Estas criaturas son mucho más que Monos-de-Mar.

Health & Welfare
Camarón sin ablación de Seajoy responde a preocupación emergente de bienestar
La remoción del tallo o pedúnculo ocular de camarones hembras reproductoras ha ayudado en el crecimiento explosivo de la acuacultura a escala comercial. Un compromiso de un productor de camarones de América Central ha demostrado que la producción de camarones sin ablación puede aliviar las preocupaciones de bienestar animal sin la temida caída en la producción.

Health & Welfare
Investigadores examinan el potencial de resistencia a los antimicrobianos en la acuacultura
La influencia de los antibióticos en los peces y sus efectos en el microbioma intestinal no se comprende bien, según un equipo de investigación que analiza la resistencia a los antimicrobianos.

Responsibility
Opinión: El camino adelante para la acuacultura es abrazar la gestión zonal
La idea de que la salud y la seguridad de las granjas acuícolas están interconectadas no es nueva. Incluso las granjas mejor gestionadas no están protegidas de enfermedades o la contaminación de otra granja cercana, por lo que son necesarias medidas adicionales, argumenta Anton Immink de Sustainable Fisheries Partnership.



