El nuevo método descrito es una herramienta de diagnóstico adicional para la confirmación del patógeno bacteriano de hepatopancreatitis necrotizante

La hepatopancreatitis necrotizante (NHP) es una enfermedad bacteriana entérica causada por una bacteria gram-negativa clasificada como Hepatobacter penaei (NHPB). Afecta a los camarones peneidos cultivados en varios países de las Américas, incluidos Estados Unidos, México, Belice, El Salvador, Guatemala, Honduras, Costa Rica, Nicaragua, Panamá, Brasil, Colombia, Ecuador, Perú y Venezuela.
El NHP es una enfermedad crónica que causa mortalidades de hasta 50 a 95 por ciento en postlarvas (PL), juveniles y reproductores de camarón blanco del Pacífico (Penaeus vannamei) afectados. La manifestación de signos clínicos de NHP a nivel de granja depende de las condiciones ambientales como la alta salinidad y la alta temperatura. Los camarones infectados con NHP muestran un caparazón blando típico, cuerpos flácidos, consumo reducido de alimento y tractos digestivos vacíos.
El curso de la infección por NHP tiene dos fases: fases aguda y crónica. Las lesiones de fase aguda en los camarones afectados por NHP incluyen necrosis y desprendimiento de las células epiteliales en el hepatopáncreas (HP) y túbulos de HP melanizados. En la fase crónica, las lesiones de HP se caracterizan por atrofia de los túbulos, disminución de la altura de las células epiteliales, bajo almacenamiento de lípidos en células R, y edema intratubular.
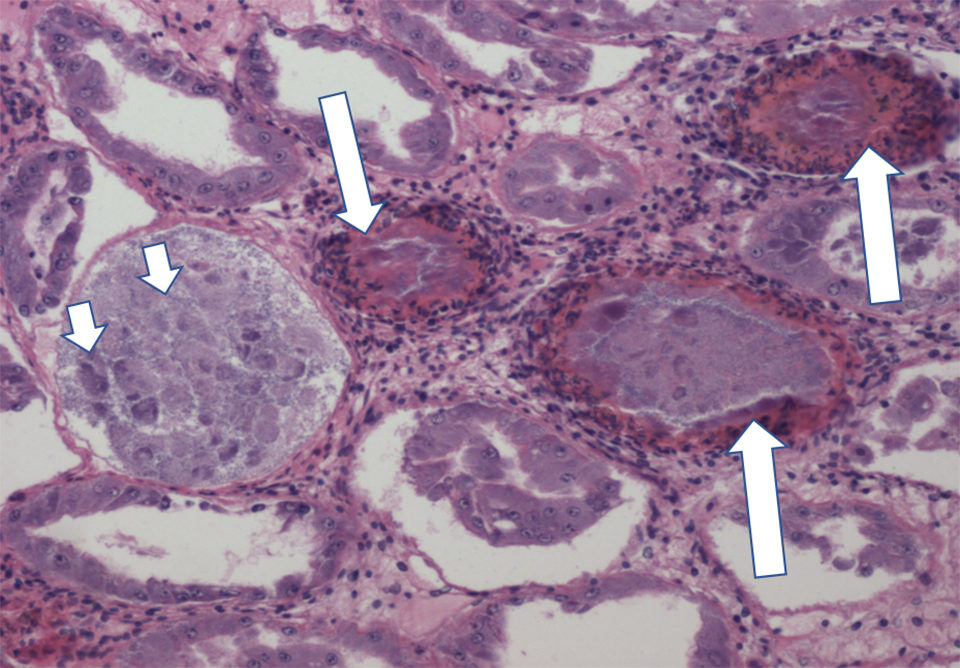
Desde el primer reporte en 1988, el NHP se ha convertido en una enfermedad tan importante en la industria del cultivo de camarón en el Hemisferio Occidental que, en 2010, fue incluida en la Lista de Enfermedades de Crustáceos de la Organización Mundial de Sanidad Animal (OIE). Se han desarrollado varios métodos de diagnóstico para detectar y confirmar la presencia de NHPB, incluida la reacción en cadena de la polimerasa (PCR), la histología y la hibridación in situ y el qPCR. Sin embargo, solo hay un método de PCR recomendado en el manual de la OIE y eso crea la necesidad de tener ensayos alternativos de PCR y PCR en tiempo real (qPCR) para la detección y confirmación de NHPB.
Los ensayos actuales de PCR y qPCR basados en la amplificación del gen 16S rRNA desarrollado en el Laboratorio de Patología Acuícola de la Universidad de Arizona (UAZ-APL) son los únicos métodos recomendados en el manual de la OIE para la detección de NHPB. Aunque estas técnicas son bastante sensibles y específicas para la detección de NHPB en camarones, en años recientes, ocasionalmente se han observado amplificaciones no específicas en el PCR de punto final cuando se analizan muestras de NHPB en quistes de artemia que fueron enviados al UAZ-APL.
Mejorando la especificidad de detección de NHPB
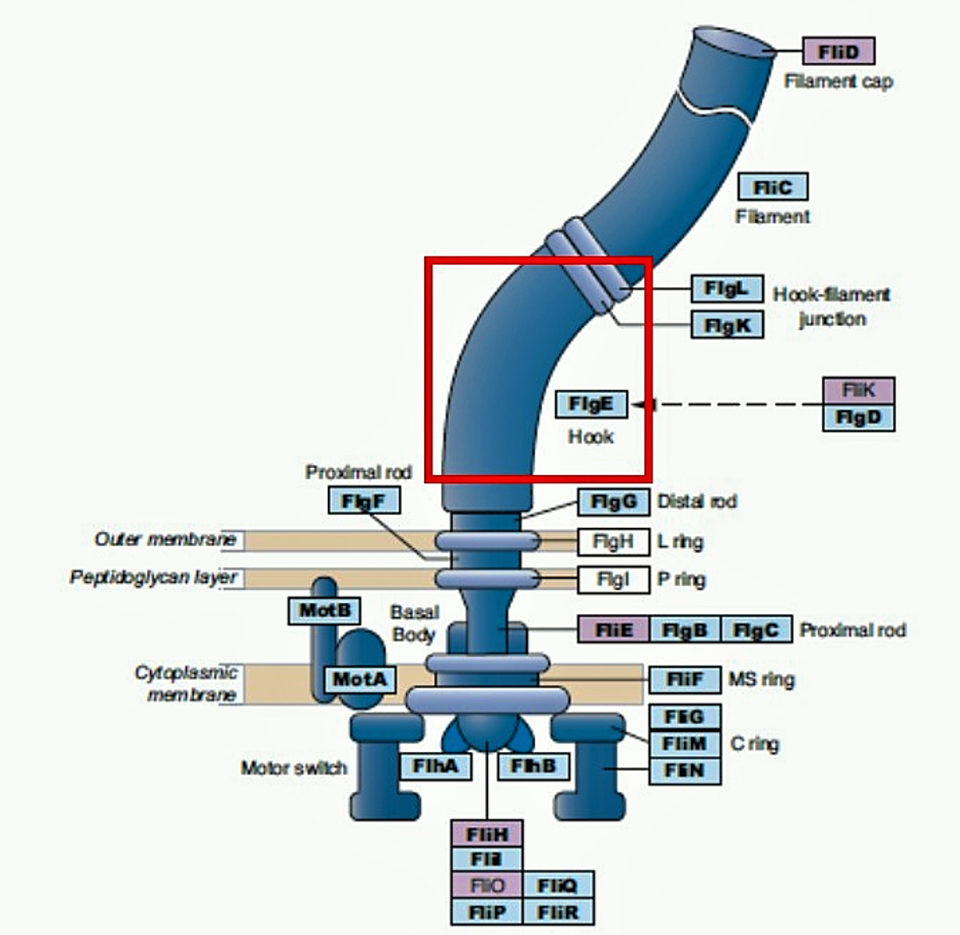
Para mejorar la especificidad de la detección de NHPB por PCR y PCR en tiempo real, nos dirigimos a una región del gen de flagelos de NHPB, llamada proteína de gancho de flagelos (flgE), que está presente solo en bacterias flageladas. Los genes de flagelos han evolucionado y divergieron de una manera específica de linaje en los diferentes grupos bacterianos, lo que hace que esta región del gen sea altamente específica para la detección de NHPB.
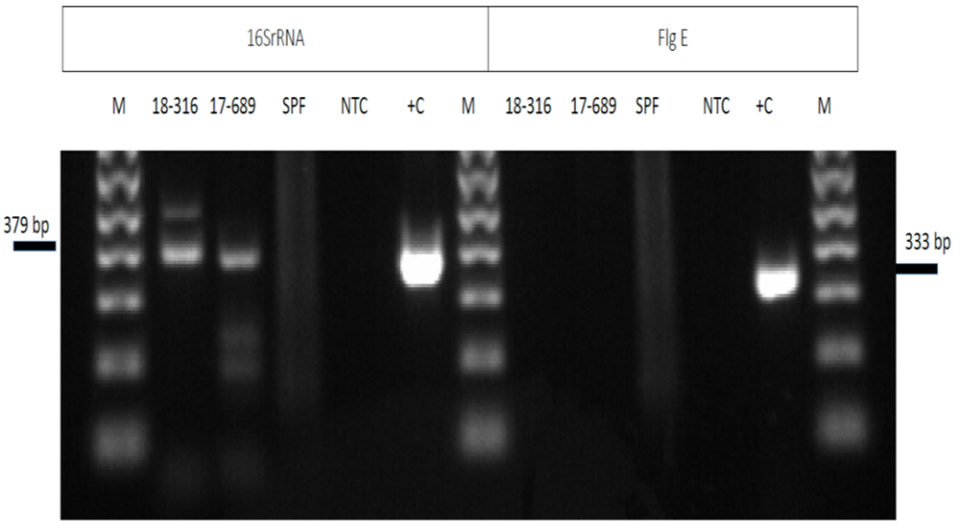
La electroforesis en gel de agarosa de los amplicones de PCR utilizando los cebadores de rRNA 16S de dos muestras (18-316 y 17-689 en el panel izquierdo de la Fig. 3) de quistes de artemia mostraron algunas bandas no específicas de 379 pb (Fig. 3). El panel del lado derecho muestra el mismo conjunto de muestras amplificadas con los cebadores flgE. A diferencia de la amplificación que utiliza los cebadores 16S rRNA, la amplificación con los cebadores flgE no muestra productos de amplificación en el gel de electroforesis. La secuenciación del amplicón a partir de los cebadores de rRN 16Sr confirmó el producto de amplificación inespecífica.
We also developed a new real-time PCR method targeting the same flgE region and by using a TaqMan hydrolysis probe (designed to increase the specificity of quantitative PCR). The new real-time PCR assay for NHPB did not provide any non-specific amplification, as obtained with the current OIE real-time PCR assay, and has a detection limit of 100 copies and a log-linear range of up to 108 copies.
Sensibilidad
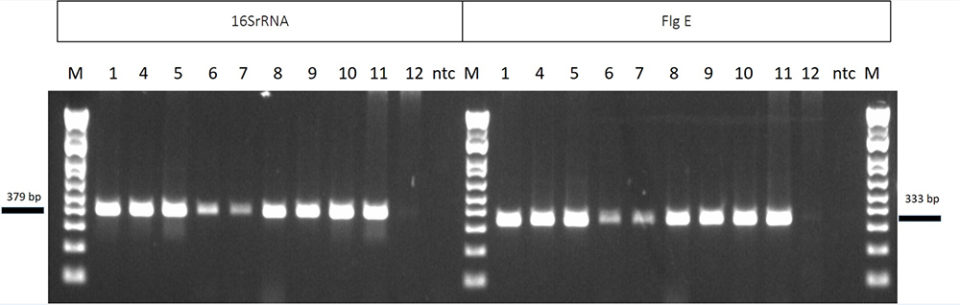
La sensibilidad analítica del nuevo PCR de NHP se determinó utilizando 10 muestras positivas de NHPB de siete orígenes con dos conjuntos diferentes de cebadores: 16S rRNA y flg E. En la Fig. 4, el lado izquierdo del gel de agarosa muestra muestras amplificadas usando el método actual recomendado por la OIE (16S rRNA); en el lado derecho están las mismas muestras amplificadas por el nuevo método. Ambos métodos proporcionaron resultados similares y una intensidad similar de las bandas de ADN en el gel de agarosa.
Con el fin de determinar la especificidad de la amplificación utilizando el protocolo basado en el gen flgE, el ADN extraído de camarones infectados con enfermedades virales – incluyendo IMN, YHD, IHHN, WSD y TS – y las enfermedades bacterianas, incluyendo V. parahaemolyticus, V. harveyi, Spiroplasma penaei – V. parahaemolyticus causante de AHPND y NHPB – se utilizaron como plantillas para la amplificación por PCR. Se obtuvieron resultados negativos para todas las enfermedades del camarón, excepto NHPB. Esto indica la alta especificidad de los cebadores utilizados para la amplificación del gen flgE en la detección de NHPB.
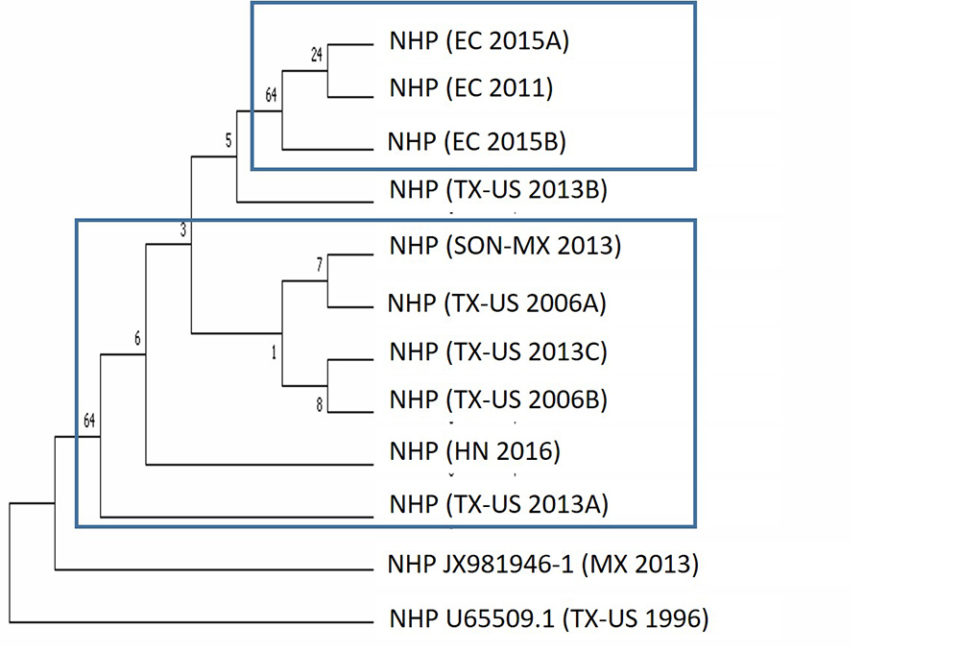
También investigamos la relación filogenética de aislados de NHPB obtenidos de diferentes regiones geográficas. Las muestras positivas de NHPB utilizadas en este estudio se originaron en Texas, EE. UU. (muestras a y b de 2016), Ecuador (2011), México (2013), Texas, EE. UU. (muestras a, b & c de 2013), Ecuador (muestras a & b desde 2015) y Honduras (2016). El análisis filogenético basado en el gen 16S rRNA mostró dos grupos: un grupo contenía aislados de Ecuador, mientras que el segundo grupo contenía aislados de México y Texas, EE. UU. (Fig. 5). Las muestras de Ecuador en 2011 y 2015 se agruparon en el mismo grupo, lo que sugiere la presencia del mismo aislado de NHPB.
Implicaciones de NHPB a nivel de granja
Se ha reportado NHP en sub-adultos y poblaciones de reproductores en granjas, causando diferentes patrones de mortalidad en las Américas. En algunos países, como en Colombia, el NHP no causa mortalidades graves como se reporta en otros países, y los signos clínicos típicos del NHP no siempre son detectados. Este fenómeno podría estar relacionado con la resistencia de algunas líneas de P. vannamei al NHP. También es posible que los aislados de NHPB puedan variar en su patogenicidad, lo que podría explicar el diferente patrón de mortalidad en diferentes regiones.
Perspectivas
Describimos ensayos de PCR convencional y de PCR en tiempo real basados en el gen flgE de NHPB como métodos alternativos para la detección y cuantificación de NHPB en muestras de camarones y asociadas con camarones, incluida artemia.
Ambos ensayos son altamente específicos y sensibles. La sensibilidad del PCR de NHP flgE es similar al método de la OIE recomendado actualmente, pero debido a su mayor especificidad en comparación con el método actual de la OIE, el método recién descrito será una herramienta de diagnóstico adicional para la confirmación de este patógeno.
Referencias disponibles del primer autor.
Now that you've reached the end of the article ...
… please consider supporting GSA’s mission to advance responsible seafood practices through education, advocacy and third-party assurances. The Advocate aims to document the evolution of responsible seafood practices and share the expansive knowledge of our vast network of contributors.
By becoming a Global Seafood Alliance member, you’re ensuring that all of the pre-competitive work we do through member benefits, resources and events can continue. Individual membership costs just $50 a year.
Not a GSA member? Join us.
Authors
-

Luis Fernando Aranguren, Ph.D.
Corresponding author
Aquaculture Pathology Laboratory
School of Animal and Comparative Biomedical Sciences
The University of Arizona
Tucson, Arizona, USA
lfarangu@email.arizona.edu
-

Arun K. Dhar, Ph.D.
Associate Professor & Director
Aquaculture Pathology Laboratory
School of Animal and Comparative Biomedical Sciences
The University of Arizona
Tucson, Arizona, USA
Tagged With
Related Posts

Health & Welfare
Unos zapatos grandes para llenar: Dhar toma las riendas en el laboratorio de patología de camarón
Arun Dhar, Ph.D. tratará de llenar los "zapatos grandes" del Dr. Donald Lightner en el Laboratorio de Patología Acuícola de la Universidad de Arizona, donde se diagnosticó la enfermedad EMS del camarón.

Health & Welfare
La historia y el futuro del Laboratorio de Patología Acuícola
El Laboratorio de Patología Acuícola de la Universidad de Arizona ha contribuido significativamente a la expansión de la cría de camarones durante tres décadas.

Health & Welfare
Construyendo un mejor pre-criadero de camarones, parte 1
Los sistemas de pre-criadero de camarones ofrecen una oportunidad importante para aumentar los beneficios. Los pre-criaderos adecuadamente diseñados y operados son instalaciones altamente bioseguras para criar postlarvas a densidades muy altas. El objetivo es producir juveniles fuertes, sanos y uniformes con un potencial significativo de crecimiento compensatorio después de su transferencia para el crecimiento final en estanques.

Health & Welfare
Cuatro cepas de AHPND identificadas en granjas de camarón de América Latina
Se conocen dos genes de virulencia que codifican una toxina binaria de Photorhabdus relacionada con insectos que causa la enfermedad de necrosis hepatopancreática aguda en camarones. Las patogenicidades de estas cepas de V. campbellii fueron evaluadas mediante infección de laboratorio y posterior examen histológico en camarones P. vannamei.


