Virus causando graves mortalidades en el camarón blanco del Pacífico en China
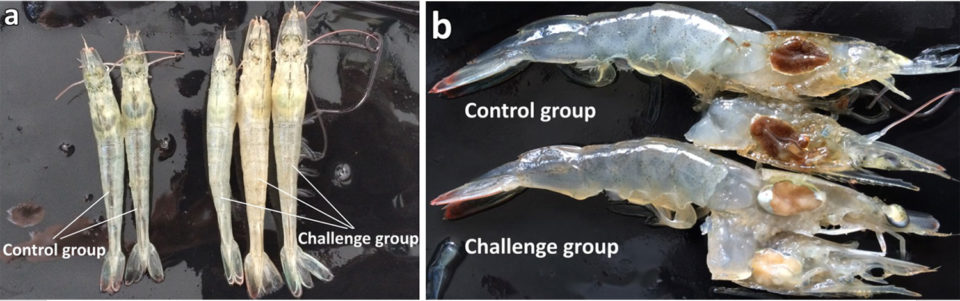
Un virus iridiscente recién descubierto que causa una enfermedad grave y una alta mortalidad en el camarón blanco cultivado (Litopenaeus vannamei) en Zhejiang, China, ha sido verificado y nombrado provisionalmente como virus iridiscente de hemocitos de camarón (SHIV). Este artículo resume la publicación original (DOI: 10.1038 / s41598-017-10738-8).
Nota del editor: hay 12 coautores en este estudio, pero solo enumeramos el correspondiente. Consulte la publicación original para obtener los nombres y afiliaciones de todos los coautores.
Fondo
En los últimos años, las epizootias (brotes localizados) de enfermedades infecciosas en L. vannamei cultivados han causado pérdidas económicas masivas en China. El SHIV se detectó e identificó por primera vez en muestras de L. vannamei(2 a 3 cm) cultivado un estanque recolectadas en una granja en la provincia de Zhejiang, China, en diciembre de 2014. Los animales afectados experimentaron muertes masivas y exhibieron atrofia hepatopancreática con color que se desvanecía, estómagos y tractos intestinales vacíos, y conchas blandas. Los resultados de las pruebas con técnicas de reacción en cadena de la polimerasa (PCR) mostraron que las muestras eran negativas para varios virus de camarón conocidos, incluidos WSSV, IHHNV, VPAHPND, YHV y TSV11.
Además, los resultados de una encuesta epidemiológica indicaron que este podría no ser el primer brote en esta granja. Un total de 89 individuos de 575 L. vannamei, 5 de 33 individuos de camarón blanco chino (Fenneropenaeus chinensis) y 5 de cada 10 camarones de agua dulce gigantes (Macrobrachium rosenbergii) dieron positivos a SHIV en muestras recolectadas durante 2014-2016 en 20 condados de cinco provincias sobre China, lo que plantea la preocupación de que el virus se haya extendido ampliamente a las áreas de cultivo de camarón en los alrededores.
Jie, SHIV, Tabla 1
| Especie de camarón | Negativo | Positivo | Total | Tasa positiva |
|---|---|---|---|---|
| L. vannamei | 486 | 89 | 575 | 15.5% |
| F. chinensis | 28 | 5 | 33 | 15.2% |
| Mb. rosenbergii | 5 | 5 | 10 | 50.0% |
| Mp. japonicas | 7 | 0 | 7 | 0.0% |
| TOTAL | 526 | 99 | 625 | 15.8% |
Los síntomas clínicos de la infección por SHIV incluyen una leve pérdida de color en la superficie y corte de hepatopáncreas, estómago y tracto intestinal vacíos, cáscara blanda en camarones parcialmente infectados, y cuerpo ligeramente rojizo en un tercio de los individuos. Estos síntomas no son similares a los causados por la infección con otros supuestos iridovirus en otras especies de camarones peneidos, camarones sergestidos o langostas de agua dulce.
Las secciones histológicas revelaron que la enfermedad podría ser causada por una infección viral presunta con síntomas patógenos evidentes, que no coincidían con las características histopatológicas de la infección con ningún virus conocido o enfermedad de necrosis hepatopancreática aguda (AHPND). Usando tecnologías de secuenciación de ADN de alto rendimiento, determinamos que un virus iridiscente potencial estaba presente en una muestra y que el análisis filogenético de las dos proteínas no era compatible con este virus iridiscente, denominado provisionalmente como virus iridiscente de hemocitos de camarón (SHIV). a cualquier género conocido de la familia Iridoviridae.
Pruebas de desafío y examen histopatológico
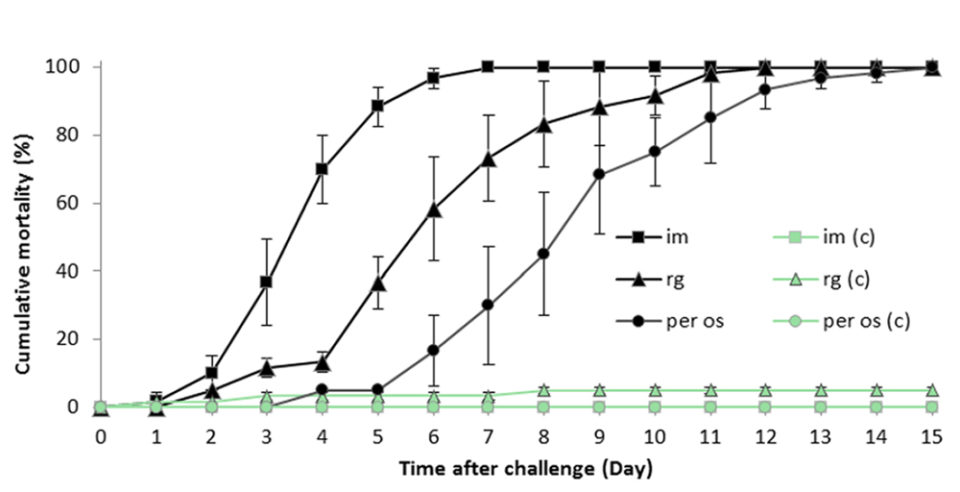
Llevamos a cabo pruebas de desafío mediante inyecciones intramusculares invasivas o modo no invasivo, incluida la sonda inversa o la infección per os, que podrían pasar con éxito un agente infeccioso filtrable de la enfermedad desde L. vannamei a animales sanos, y causamos síntomas clínicos y cambios patológicos similares, lo que prueba que este virus es el agente causante de la enfermedad.
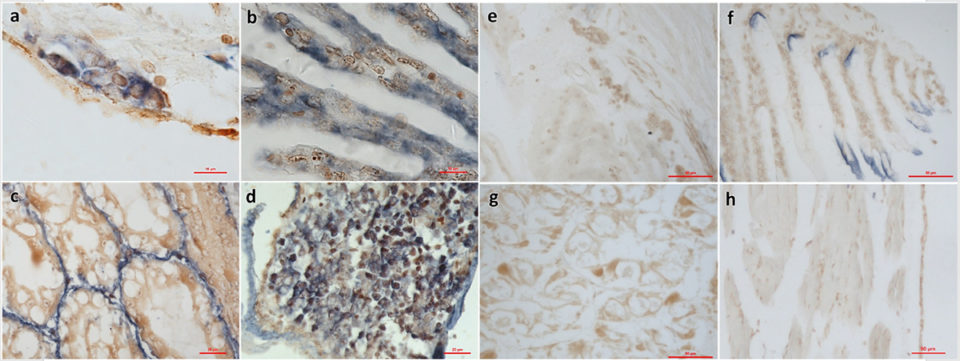
También utilizamos Hibridación in Situ (ISH) con una sonda específica para detectar SHIV en secciones de L. vannamei infectados. La ISH es una técnica molecular que muestra la ubicación de secuencias específicas de ácido nucleico en tejidos o en cromosomas; esta es una etapa crítica para comprender la regulación, organización y función de los genes.
La sonda reaccionó a las lesiones histológicas en tejido hematopoyético y hemocitos en branquias, hepatopáncreas y periópodos obtenidos de una muestra, así como en tejidos del experimento de desafío descrito en este estudio. Nuestros resultados cumplieron con los postulados de Rivers, creados en 1973 por Thomas M. Rivers para establecer el papel de un virus específico como la causa de una enfermedad específica, para la demostración de una etiología viral.
El examen histopatológico de tejidos de muestra reveló inclusiones basófilas y picnosis en tejido hematopoyético y hemocitos en branquias, hepatopáncreas, periópodos y músculos. Utilizando la técnica de secuenciación de metagenómica viral (a partir de material genético recuperado directamente de muestras ambientales), obtuvimos secuencias parciales que interpretamos como iridoviridae potencial. Y los análisis filogenéticos que utilizan secuencias de aminoácidos de proteínas principales revelaron que se trata de un nuevo virus iridiscente, pero que no pertenece a los cinco géneros conocidos de Iridoviridae.
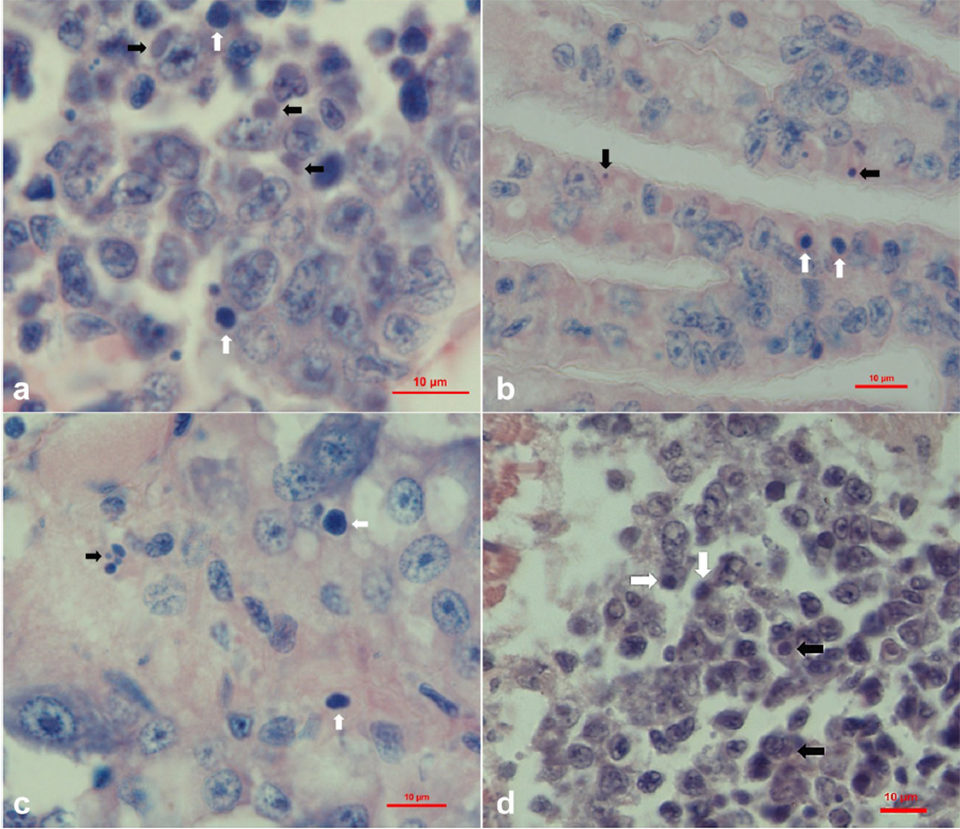
Después de haber comparado las características morfológicas, fisiológicas y filogenéticas de nuestras muestras con las de otros virus iridiscentes, asignamos temporalmente al agente etiológico como virus iridiscente hemocítico de camarón (SHIV), que podría causar la enfermedad del virus iridiscente de hemocitos de camarón (SHIVD). Sugerimos un nuevo género de Iridoviridae, Xiairidovirus, que significa virus iridiscente de camarón.
Perspectivas
A través del aislamiento, la reinfección y la caracterización histopatológica, hemos revelado que el SHIV es un nuevo virus en la familia Iridoviridae y un patógeno de L. vannamei. Además, hemos desarrollado un ensayo ISH y un método de PCR anidado para la detección específica de SHIV.
Los hallazgos de nuestro estudio enfatizan la necesidad de que los profesionales bien preparados en salud de animales acuáticos y los productores con experiencia en la industria acuícola de camarón presten mayor atención a SHIV y tomen medidas más efectivas para prevenir los brotes de enfermedades y las pérdidas económicas causadas por SHIV.
Now that you've reached the end of the article ...
… please consider supporting GSA’s mission to advance responsible seafood practices through education, advocacy and third-party assurances. The Advocate aims to document the evolution of responsible seafood practices and share the expansive knowledge of our vast network of contributors.
By becoming a Global Seafood Alliance member, you’re ensuring that all of the pre-competitive work we do through member benefits, resources and events can continue. Individual membership costs just $50 a year.
Not a GSA member? Join us.
Author
-
Dr. Jie Huang
Corresponding author
Yellow Sea Fisheries Research Institute
Chinese Academy of Fishery Sciences
Qingdao, China
Tagged With
Related Posts

Health & Welfare
Construyendo un mejor pre-criadero de camarones, parte 1
Los sistemas de pre-criadero de camarones ofrecen una oportunidad importante para aumentar los beneficios. Los pre-criaderos adecuadamente diseñados y operados son instalaciones altamente bioseguras para criar postlarvas a densidades muy altas. El objetivo es producir juveniles fuertes, sanos y uniformes con un potencial significativo de crecimiento compensatorio después de su transferencia para el crecimiento final en estanques.

Health & Welfare
Evaluación de una dieta funcional comercial en camarones blancos juveniles del Pacífico infectados con AHPND
Una serie de experimentos – incluyendo ensayos in vitro, in vivo y también de campo, investigaron si una dieta funcional podría reducir el AHPND en el camarón blanco del Pacífico.

Health & Welfare
Posibles aplicaciones de bacteriófagos para el control de AHPND
Un estudio demuestra que los fagos aislados probados son efectivos para controlar la infección por AHPND en camarones peneidos cultivados e inhibir el crecimiento bacteriano.

Intelligence
Podemos crecer un mejor camarón, y de mejores maneras
El reciente Simposio Centroamericano de Acuicultura en Choluteca, Honduras, reunió a más de 600 participantes para discutir temas de la industria y sus perspectivas. La atención se centró en enfermedades del camarón y sus impactos en la producción, así como en alternativas prácticas.



